Die segensreiche Wirkung von Impfstoffen im Allgemeinen und jener gegen Covid-19 im Besonderen sind für jeden, der Statistiken lesen und interpretieren kann, unbestritten. Bei allen Impfungen kann es – wie bei jeder medizinischen Behandlung – natürlich zu Nebenwirkungen kommen. Diese sind allerdings im Vergleich zu den durch die jeweilige Erkrankung verursachten Schäden um viele Grössenordnungen seltener und viel geringfügiger. Trotzdem ist es wichtig, sich mit solchen Nebenwirkungen zu beschäftigen, was auch i.R. dieses Beitrages zu unserer „Corona-Splittern“ geschehen soll.
Nach Verabreichung von Vektor-basierten Impfstoffen gegen SARS-CoV2, dem Erreger von Covid-19 – zuerst jenes von Astra Zeneca (AZ) und nach der kürzlich erfolgten Zulassung in Österreich auch jenes von Johnson & Johnson (JJ) – kam es bekanntlich in sehr seltenen Fällen zu thrombotischen Komplikationen, insbesondere auch zu solchen, die die zerebralen Sinusvenen betreffen.
Eine erste Publikation über derartige Fälle in Deutschland und Österreich (1) hat grosse Aufmerksamkeit erregt. Inzwischen wurden diese Beobachtungen in anderen Arbeiten bestätigt (2). Die in den ersten zwei Wochen nach Verabreichung von Vektorimpfstoffen gegen verschiedene Infektionskrankheiten sehr selten beobachteten Gerinnungsstörungen ähneln jenen bei der bekannten Heparin-induzierten Thrombozytopenie (HIT), für deren serologische Diagnose von unsals eine der ersten Gruppen Labortests entwickelt wurden (3,4,5). Interessanterweise wurde nun im Ausschlussverfahren gezeigt, dass die PatientInnen mit Thrombosen nach einer Covid-19 Impfung Thrombozyten-aktivierende (Auto)Antikörper gegen den Plättchenfaktor 4 (PF4) bzw. Komplexe von PF4 mit Polyanionen entwickeln, obwohl sie kein Heparin erthalten hatten und in menschlichem Körper auch kein Heparin produziert wird. Das erwähnte diagnostische Ausschlussverfahren bestand darin, dass die PatientInnen systematisch mit allen zur Verfügung stehenden Tests zum Nachweis von (Auto)Antikörpern gegen Thrombozyten oder deren Produkte getestet wurden und sich nur die Reaktion gegen PF4 und PF4-assoziierte Komplexe als positiv erwiesen. Nach diesen methodengetriebenen Resultaten klinischer Forschung sind nun viele Arbeitsgruppen damit beschäftigt, die diesem Phänomen zugrundeliegender Mechanismen mittels hypothesengetriebener Forschungsansätze aufzuklären (6).
Dieses Krankheitsbild wird jetzt als Vaccine-Induced Immune Thrombozytopenia (VITT) bezeichnet. Als mögliche Ursachen wurden u.a. Aminosäuresequenzhomologien zwischen Komponenten der Impfstoffe und autologen menschlichen Proteinen, wie eben z.B. PF4, diskutiert. Im AZ Impfstoff werden Adenoviren von Schimpansen (ChAdOx1), in jenem von JJ das humane Ad26 Virus als Vektor verwendet. Ersteres bindet an den Coxsackie und Adenovirusrezeptor (CAR), letzteres an das Protein CD46, das auch als Rezeptor für das Masern- und das humane Herpesvirus 6 fungiert. Mittels dieser Vektoren wird die virale DNA, welche für das Spike(S)-Protein von SARS-Cov2 codiert, in den Empfänger des Impfstoffs transportiert, wo dann das chemisch leicht modifizierte S-Protein exprimiert und als Antigen wirksam wird. In der Literatur sind bereits zahlreiche Sequenzhomologien zwischen dem S-Protein und verschiedenen humanen Proteinen dokumentiert auf deren Basis sich eine immunologische Kreuzreaktion, ein sogenanntes „Antigenes Mimikry“, entwickeln und so zu einer Autoimmunreaktion führen kann (7,8). Im Fall der VITT wird auch eine Komplexbildung von aus den Vektoren freigesetzter DNA und PF4 mit nachfolgender Antikörperbildung gegen solche Komplexe diskutiert. PF4 ist positiv geladen und kann negative geladene Moleküle – wie heparinähnliche Substanzen – binden. Ausserdem wurde gezeigt, dass ein nicht unerheblicher Teil von klinisch gesunden Personen ohne Kontakt mit Heparin (ca. 4,3%) aus unbekannter Ursache bereits Antikörper gegen PF4 aufweist (9). Diese „Basis-Antikörperproduktion“ könnte bei manchen dieser Kandidaten durch einen Vektor-Impfstoff verstärkt werden. Auch die i.R. von Covid-19 auftretende, vermehrte Produktion proinflammatorischer Zytokine (z.B. IL-6, IL-8, TNFα, etc.) scheint durch Vektor-basierte Impfstoffe – natürlich in weit geringerem Grad als die Krankheit selbst – zu einer erhöhten Aktivierung des Gerinnungssystems und damit zur Thromboseneigung zu führen, wenn eine entsprechende genetische Prädisposition besteht (10). (Die Inzidenz von schweren Thrombosen nach Covid-19 Impfungen betrug bis Ende März 2021 in Europa lediglich 86/25 Mill.!)
Ein in diesem Zusammenhang wenig beachteter Faktor ist die Tatsache, dass Adenovieren, die in modifizierter Form als Vektoren in Impfstoffen dienen, in Kulturen menschlicher Zellen (z.B. humanen embryonic kidney – HEK-Zellen) produziert werden. Die Impfstoffe enthalten daher ggfs. noch zahlreiche humane Proteine, die – in ev. veränderter Struktur – zur Produktion von Autoantikörpern führen können.
Jedenfalls aktivieren anti-PF4 Antikörper Thrombozyten und regen neutrophile Granulozyten indirekt zur Thrombosebildung an (11)
Warum sind die Sinusvenen im Gehirn besonders von thrombotischen Komplikationen betroffen?
Das liegt an den dort herrschenden anatomischen Verhältnissen!Die Sinusvenen sind bekanntlich in der Dura mater lokalisiert und dort relativ starr eingespannt. Das ist auch der Grund für ihren dreieckigen Querschnitt.
Im Gegensatz zu anderen venösen Gefäßen ist ihre Wand also sehr unelastisch, und sie können sich Positionsänderungen, wie plötzlichem Aufstehen oder Niederlegen, nur schlecht anpassen, können also beispielsweise nicht kollabieren. Die Sinusvenen haben ausserdem keine Klappen, und das Blut kann sich in ihnen daher in beide Richtungen bewegen, bzw. tendiert zum Stau. Dazu trägt im gegebenen Fall die Tatsache bei, dass diese Impfstoffe im besonderen Mass fähig sind, Endothelzellen, das Komplementsystem und das Gerinnungssystem zu aktivieren. Schliesslich treten Sinusvenenthrombosen v.a. bei jüngeren Frauen auf, die kontrazeptive Pillen einnehmen, ein weiterer Umstand, der die Blutgerinnung verstärkt.
Sinusvenenthrombosen sind daher auch eine – im Vergleich zu der hier diskutierten Wechselwirkungen von Impfstoffen (1,57 Fälle/100.000 Personenjahren!) – relativ häufige Komplikation von kardiovaskulären Operationen.
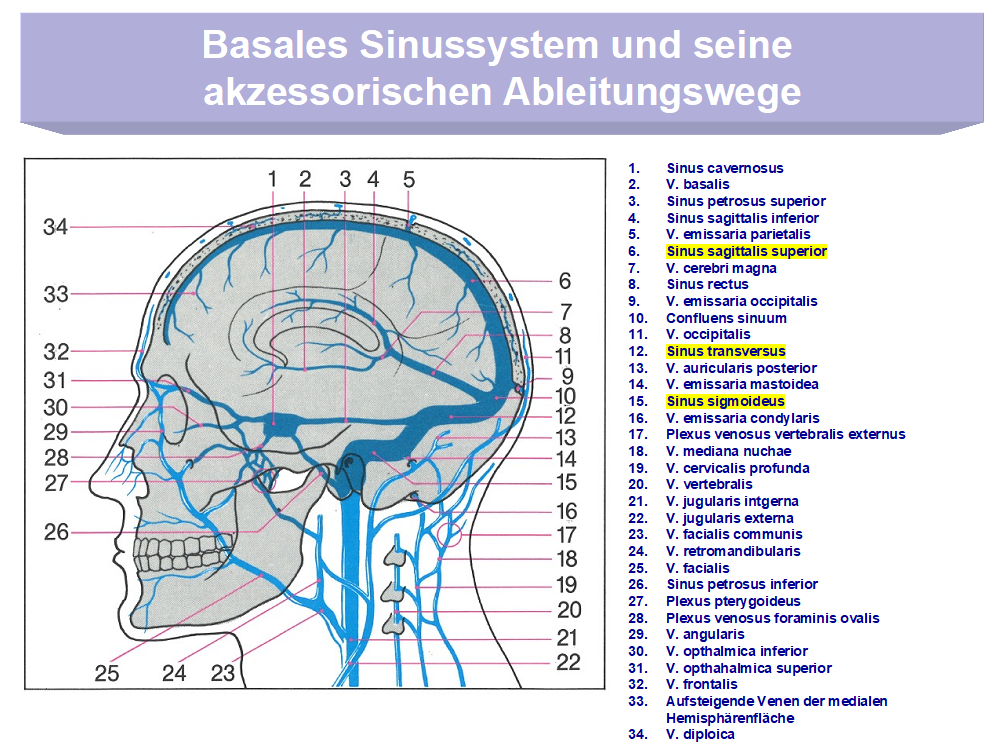
Einige der zahlreichen Sinusvenen, die besonders anfällig für die Entwicklung von Thrombosen sind, sind in Abb. 1 farblich markiert. Von dort können sich dann die Thrombosen auf die Brückenvenen ausdehnen, die ihrerseits in die duraeingefassten, starren Sinus einmünden (Abb.2).
Abbildung 1:
Referenzen:
(1)
Greinacher, A., Thiele, T., Warkentin, T. E., Weisser, K., Kyrle, P. A., & Eichinger, S. (2021). Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. New England Journal of Medicine. Published. https://doi.org/10.1056/nejmoa2104840
(2)
Schultz, N. H., Sørvoll, I. H., Michelsen, A. E., Munthe, L. A., Lund-Johansen, F., Ahlen, M. T., Wiedmann, M., Aamodt, A. H., Skattør, T. H., Tjønnfjord, G. E., & Holme, P. A. (2021). Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. New England Journal of Medicine. Published. https://doi.org/10.1056/nejmoa2104882
(3)
Wolf, H., Nowack, H., & Wick, G. (1983). Detection of Antibodies Interacting with Glycosaminoglycan Polysulfate in Patients Treated with Heparin or Other Polysulfated Glycosaminoglycans. International Archives of Allergy and Immunology, 70(2), 157–163. https://doi.org/10.1159/000233315
(4)
Wolf, H., Glassl, H., Nowack, H., & Wick, G. (1986). Identification of Binding Site for Heparin and Other Polysulfated Glycosaminoglycans on Human Thrombocytes. International Archives of Allergy and Immunology, 80(3), 231–238. https://doi.org/10.1159/000234058
(5)
Wolf, H., & Wick, G. (1986). Antibodies interacting with, and corresponding binding site for, Heparin on human thrombocytes. The Lancet, 328(8500), 222–223. https://doi.org/10.1016/s0140-6736(86)92523-7
(6)
Greinacher, A., Selleng, K., Wesche, J., Handtke, S., Palankar, R., Aurich, K., Lalk, M., Methling, K., Völker, U., Hentschker, C., Michalik, S., Steil, L., Schönborn, L., Beer, M., Franzke, K., Rangaswamy, C., Mailer, R. K., Thiele, T., Kochanek, S., . . . Renné, T. (2021). Towards Understanding ChAdOx1 nCov-19 Vaccine-induced Immune Thrombotic Thrombocytopenia (VITT). Research Square. Published. https://doi.org/10.21203/rs.3.rs-440461/v1
(7)
Kanduc, D., & Shoenfeld, Y. (2020). On the molecular determinants of the SARS-CoV-2 attack. Clinical Immunology, 215, 108426. https://doi.org/10.1016/j.clim.2020.108426
(8)
Lucchese, G., & Flöel, A. (2020). Molecular mimicry between SARS-CoV-2 and respiratory pacemaker neurons. Autoimmunity Reviews, 19(7), 102556. https://doi.org/10.1016/j.autrev.2020.102556
(9)
Hursting, M. J., Pai, P. J., McCracken, J. E., Hwang, F., Suvarna, S., Lokhnygina, Y., Bandarenko, N., & Arepally, G. M. (2010). Platelet Factor 4/Heparin Antibodies in Blood Bank Donors. American Journal of Clinical Pathology, 134(5), 774–780. https://doi.org/10.1309/ajcpg0mnr5ngknfx
(10)
Fricke-Galindo, I., & Falfán-Valencia, R. (2021). Genetics Insight for COVID-19 Susceptibility and Severity: A Review. Frontiers in Immunology, 12. https://doi.org/10.3389/fimmu.2021.622176
(11)
Maxwell, A. J., Ding, J., You, Y., Dong, Z., Chehade, H., Alvero, A., Mor, Y., Draghici, S., & Mor, G. (2020). Identification of key signaling pathways induced by SARS‐CoV2 that underlie thrombosis and vascular injury in COVID‐19 patients. Journal of Leukocyte Biology, 109(1), 35–47. https://doi.org/10.1002/jlb.4covr0920-552rr
